1. Clasificación de las proteínas y niveles estructurales
Las proteínas son cadenas polipeptídicas que se diferencian de los oligopéptidos en
el número de aminoácidos que contienen, en su carácter funcional y sobre todo en
que son el resultado del proceso de expresión genética. La conformación de una
proteína hace referencia a la disposición espacial de la misma, aspecto de vital
importancia, pues va a estar directamente relacionado con la función que
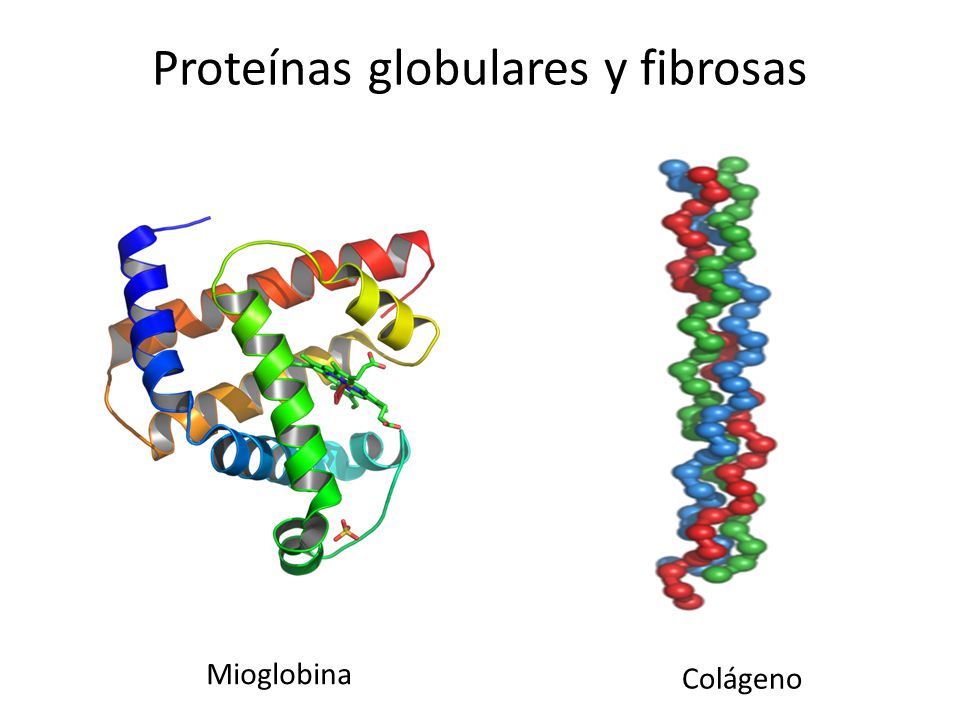
desempeñan. Según su conformación las proteínas pueden clasificarse en fibrosas
y globulares. Las proteínas fibrosas poseen las cadenas polipeptídicas ordenadas
de modo paralelo a lo largo de un eje, forman materiales físicamente resistentes e
insolubles en agua, siendo elementos básicamente estructurales como por ejemplo
la α-queratina del pelo, la fibroina de la seda o el colágeno de los tendones. Por su
parte, las proteínas globulares, están constituidas por una o varias cadenas
polipeptídicas plegadas de modo que puedan adoptar una conformación esférica o
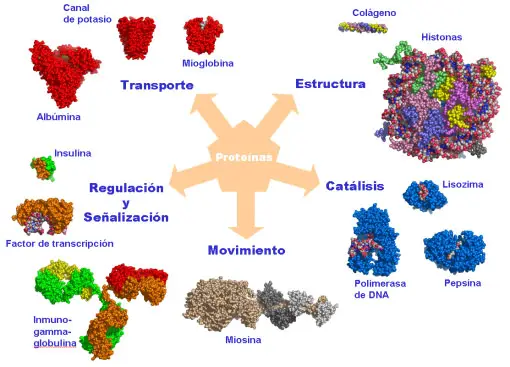
globular, desempeñando diferentes funciones, entre ellas:
• proteínas transportadoras (mioglobina)
• catalizadores (enzimas)
• protectora (anticuerpos)
• receptoras de señal (rodopsina)
• reserva (albumina)
La conformación que presenta una proteína va a depender directamente de los
distintos niveles estructurales que posee, pudiéndose observar hasta cuatro niveles
estructurales, denominados estructura primaria, secundaría, terciaria y cuaternaria,
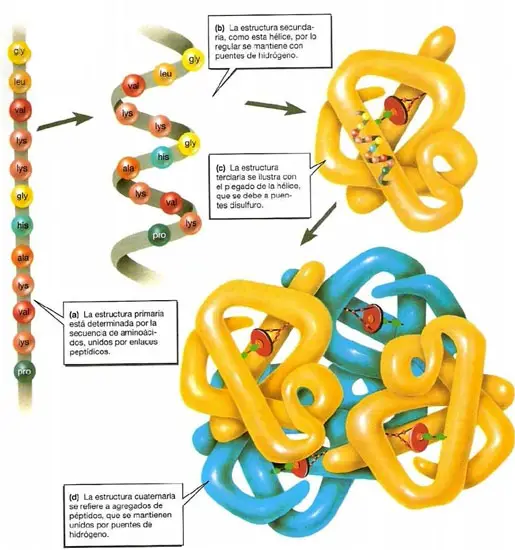
Como se estudió en el tema anterior, la estructura primaria hace referencia a
la posición que ocupa cada aminoácido en la cadena polipeptídica, es decir nos
indica la secuencia de la proteína. La importancia de este nivel radica en que la
posición que ocupa cada aminoácido dentro de la cadena va a condicionar
enormemente el resto de los niveles estructurales y en último término la función que
desempeña la proteína. Las proteínas no son sólo polipéptidos: son polipéptidos de
secuencia definida, cualquier alteración de la secuencia puede provocar cambios en
el resto de niveles e impedir el correcto funcionamiento de la proteína.
La Estructura secundaria: hace referencia a la ordenación regular y periódica de la
cadena polipeptídica en una dirección determinada. Los conocimientos sobre la
estructura secundaria tienen su origen en los estudios realizados por Linus Pauling,
de tal forma que trabajando básicamente con modelos estructurales, Pauling y sus
colaboradores pudieron llegar a un pequeño número de conformaciones regulares
que cumplían todos los criterios derivados de los estudios de difracción de rayos X.
Básicamente, se establecen dos tipos de estructura secundaria, la hélice-α y la
conformación-ß.
• En la Hélice-α la cadena polipeptídica adopta una conformación
helicoidal. Las estructuras helicoidales se caracterizan por el numero de
aminoácidos por vuelta (n) (3,6 restos en la Hélice-α) y por su paso de
rosca (p), o distancia entre vuelta (5,4 Å para la Hélice-α). Esta conformación
se estabiliza por puentes de hidrógeno (R-C=O ●●●● H-N-R) intracatenarios entre el grupo amino y el carbonilo de enlaces peptídicos
enfrentados. Además, los restos -R de los aminoácidos se disponen hacia
fuera de la hélice evitando las interacciones estéricas (por grupos
voluminosos) y estabilizando la conformación. Por otro lado, la hélice-α puede
distorsionarse o perder la conformación cuando en la secuencia aparece una
prolina, único aminoácido ciclado por su grupo α-amino.
Aunque la hélice-α es la conformación más común, es posible encontrar en
algunas proteínas hélices 310 (con 3 residuos por vuelta), e incluso es
estéricamente posible la denominada hélice π (4,4 residuos por vuelta) si bien
aun no se ha observado en las proteínas.
En la conformación-ß (Fig.3) la cadena adopta una ordenación lineal en la
que los restos -R, de los aminoácidos, se van alternando por encima y por
debajo (zig-zag) del plano del enlace peptídico. Esta conformación se
estabiliza con puentes de hidrógeno entre varias cadenas de proteínas con
conformación-ß, dando lugar a una hoja plegada ß, que puede presentar un
plegamiento paralelo, (en el que las cadenas vecinas se desarrollan en la
misma dirección), o bien un plegamiento antiparalelo con cadenas vecinas en
direcciones opuestas.
La Estructura Terciaria hace referencia al modo en que se curvan o pliegan en el
espacio los segmentos de hélice-α y/o conformación-ß, que presenta una cadena
polipeptídica de las proteínas globulares. El plegamiento de una proteína globular
hasta alcanzar su conformación espacial es un proceso claramente favorecido
termodinámicamente, es decir el cambio de energía libre global que se produce con
el plegamiento es negativo. Dicho proceso, que implicaría una reorganización
espacial y por lo tanto una disminución de entropía, se ve favorecido por
interacciones que se producen entre los residuos de os aminoácidos, entre ellas,
interacciones electrostáticas, puentes de hidrógeno, fuerzas de van der Waals,
interacciones hidrofóbicas y puentes disulfuro.
La estructura terciaria depende lógicamente de su estructura primaria, así las
cadenas laterales de los aminoácidos en las proteínas globulares se hallan
distribuidas espacialmente de acuerdo con sus polaridades, de tal forma que:
• Los restos no polares aparecen, casi siempre, en el interior de la proteína,
para no entrar en contacto con el disolvente acuoso que la envuelve,
creando un ambiente hidrofóbico.
• Los residuos polares con carga se hallan situados, normalmente en la
zona externa, interaccionando con el medio acuoso. A veces, se requiere
de estos centros en la parte interna de la proteína y en estos casos
también ocurre que están directamente implicados en alguna
funcionalidad de la proteína, bien a nivel estructural o bien a nivel
catalítico.
• Los grupos polares sin carga, aparecen distribuidos por la totalidad de la
cadena, si bien mayoritariamente, también aparecen en las partes
externas, en contacto con la disolución acuosa.
Como consecuencia de esta distribución de restos, las proteínas globulares son muy
compactas, hay poco espacio en el interior, de modo que el agua difícilmente accede
a dicho espacio.
Estructura cuaternaria. Muchas proteínas globulares son oligoméricas, es decir
están formadas por más de una cadena polipeptídica (subunidad). La posición
espacial que ocupa cada una de estas subunidades respecto a las otras queda
determinada por la estructura cuaternaria. De nuevo surgen interacciones entre los
residuos de los aminoácidos, de la misma naturaleza que las indicadas en la
estructura terciaria, y que, en este caso, además se producen entre las cadenas
polipeptídicas que conforman la proteína. Un ejemplo claro ocurre con la
hemoglobina (que se estudiará más adelante), proteína formada por 4 subunidades
Proteínas Fibrosas. Queratinas
La α-queratina es una proteína que
aparece en todos los vertebrados
superiores y es el componente
principal del pelo, la lana, las uñas o
los cuernos. El pelo (Fig. 5) está
constituido por células muertas, cada
una de las cuales contiene
macrofibrillas empaquetadas que se
orientan paralelamente a la fibra del
pelo. Éstas están formadas por
microfifrillas, que es una asociación de
protofibrillas que continúen dos
cadenas de hélice-αque se retuercen
en un arrollamiento hacia la izquierda.
Las α-queratinas poseen un alto
contenido de Cys (R= -CH2-SH) de tal
manera que las interacciones entre las hebras se producen a través de puentes
disulfuro (-S-S-) dando una gran resistencia e insolubilidad al conjunto. Aunque la
insolubilidad de las α-queratinas impide que la mayor parte de los animales la
puedan digerir, la polilla, posee una concentración elevada de mercaptanos, que
rompen los puentes disulfuro en su tracto digestivo y por lo tanto pueden digerir la
lana.
Por su parte, la Fibroína de la seda es una agrupación de ß-queratinas en
conformación hoja plegada-ß antiparalela unidas por enlaces de hidrógeno
intracatenarios. La fibroina y otras ß-queratinas son muy ricas en aminoácidos poco
voluminosos (gly y ala), lo que facilita que las hojas se apilen unas sobre otras, de tal
modo que se alternan zonas de contacto entre glicinas y zonas de contacto entre
alaninas, interaccionando mediante fuerzas débiles de van der Waals. Este hecho
hace posible que la seda pueda extenderse en fibras fácilmente separables
(separando hojas) pero relativamente difíciles de romper (implicaría romper los
enlaces peptídicos).
Proteínas Globulares. Mioglobina, Hemoglobina, Inmunoglobulinas
Algunas proteínas, como le ocurre a la mioglobina (Fig.7) están constituidas solo
por hélices-α. La mioglobina es una proteína globular que contiene una sola cadena
polipeptídica, constituida por ocho segmentos de hélice-α . La mioglobina se halla,
principalmente en las células de los músculos esqueléticos y es especialmente
abundante en los mamíferos buceadores, en los que no sólo actúa almacenando
oxígeno, sino también contribuyendo al aumento de la velocidad de difusión del
oxígeno.
La mioglobina y la hemoglobina son dos ejemplos de proteína trasportadoras, en las
que la estructura secundaria básica es de hélices-α, también existen proteínas que
mayoritariamente están formada por regiones extensas de hoja plegada-ß, como es
el caso de la concanavalina A (lectina de soja) una proteína vegetal (con
cuatro subunidades) capaz de fijar específicamente mono- u oligosacáridos de
receptores celulares de superficie, desencadenando en la célula determinadas
acciones. Por su parte, la anhidrasa carbónica (encargada de hidratar el CO2, para
producir bicabonato) es un ejemplo de proteína que posee cantidades significativas
de ambos tipos de estructura secundaria,
LAS INMUNOGLOBULINAS
El cuerpo genera diferentes inmunoglobulinas para combatir cada antígeno. Por ejemplo, el anticuerpo de la varicela no es el mismo que el anticuerpo de la mononucleosis. A veces, el cuerpo puede equivocarse y generar anticuerpos que atacan a su propio tejido, afectando a los órganos sanos ya que los identifica como cuerpos extraños. Esto es lo que se conoce como "enfermedad autoinmune".
Los cinco tipos de anticuerpos son los siguientes:
- Inmunoglobulina A (IgA), presente en grandes concentraciones en las membranas mucosas, particularmente en las paredes internas de las vías respiratorias y el tracto gastrointestinal, como también en la saliva y las lágrimas.
- Inmunoglobulina G (IgG), el tipo de anticuerpo más abundante en los líquidos corporales. Brinda protección contra las bacterias y las infecciones virales.
- Inmunoglobulina M (IgM), se encuentra principalmente en la sangre y en el líquido linfático. Es el primer anticuerpo que el cuerpo genera para combatir una infección.
- Inmunoglobulina E (IgE), se la asocia principalmente con las reacciones alérgicas (lo que ocurre cuando el sistema inmunológico reacciona de manera exagerada a los antígenos del medio ambiente, como el polen o el polvillo de los animales). Se encuentra en los pulmones, la piel y las membranas mucosas.
- Inmunoglobulina D (IgD), existe en pequeñas cantidades en la sangre y es el anticuerpo del que menos conocimiento se tiene.
Por lo general tanto la IgA como la IgG y la IgM se miden simultáneamente. Al evaluarse juntas, le brindan al médico información importante sobre el funcionamiento del sistema inmunológico, especialmente en lo relacionado con las infecciones y las enfermedades autoinmunes.


No hay comentarios:
Publicar un comentario